【四月会员培训】医疗器械设计开发及风险管理对医疗器械的应用培训班

序言
国家药监局于2022年10月发布,2023年11月实施的GB/T 42062-2022/ ISO14971:2019《医疗器械 风险管理对医疗器械的应用》,预示着新版的医疗器械风险管理标准在国内正式落地,明确了医疗器械风险管理各阶段的要求,总结了各国医疗器城风险管理的经验,并提供了方法指导,对于确保医疗器械的安全有效性,促进中国医疗器械行业的健康发展具有现实而深远的意义。
为帮助生产企业提高医疗器械风险管理意识和风险管理实效,充分理解法规和标准对风险管理的要求,掌握医疗器械风险评价及分析的方法和思路,我司特举办本次培训班。现将有关事项通知如下:
1)培训时间
培训时间:2024年4月20日(周六)
参会人员于4月20日上午8:30前至会场签到
培训方式:线上线下同时进行培训
2)培训地点常州市武进区湖塘科技产业园A6四楼(医疗器械GMP实训中心)
3)组织单位
主办单位:
常州飞凡教育科技有限公司
协办单位:
洲通健康科技(上海)有限公司
4)招生对象管代、法规、注册及研发人员
5)扫描报名

二、课程模块
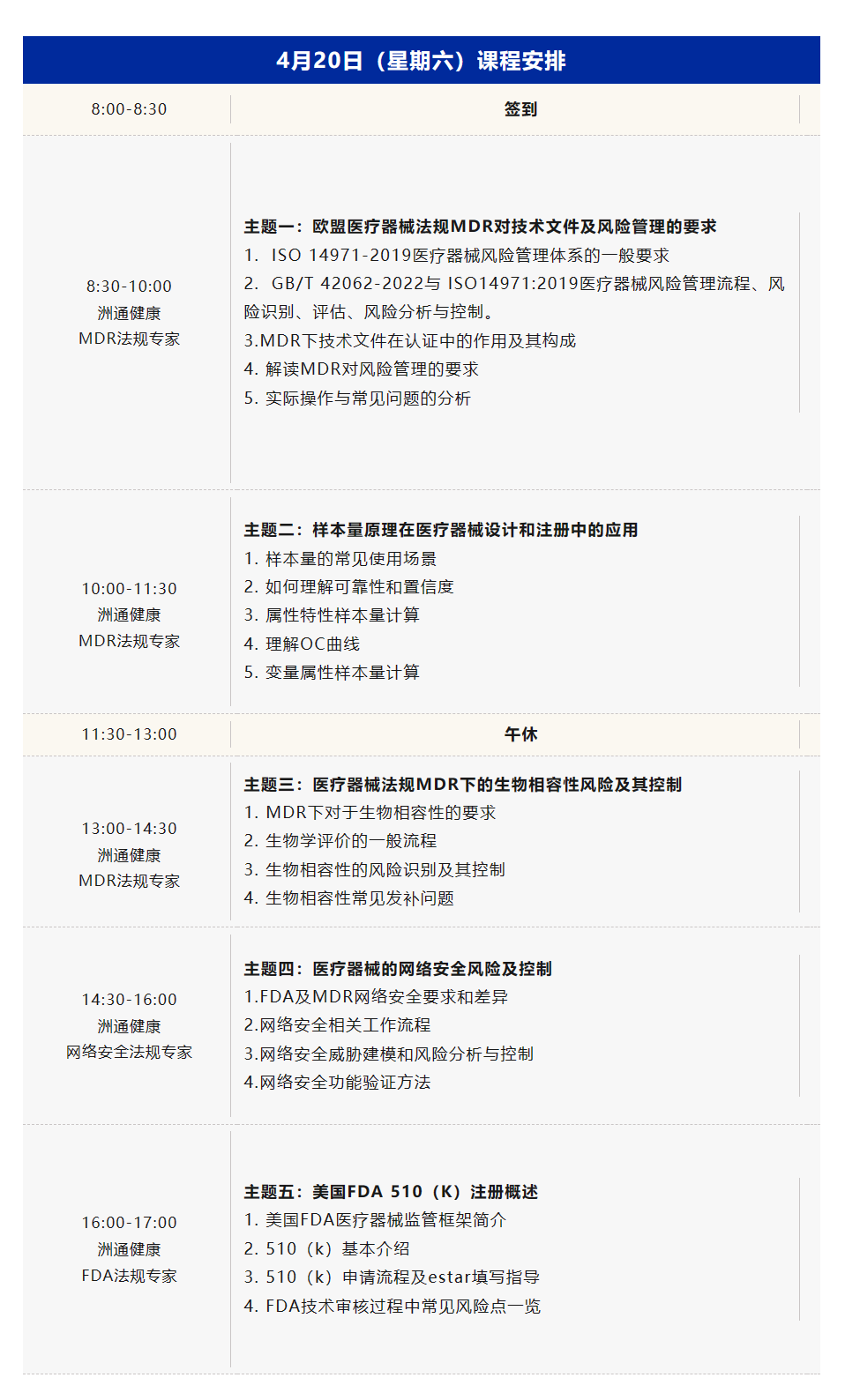
三、讲师简介
1)洲通健康MDR法规专家
♦拥有多年医疗器械法规合规注册经验,熟悉欧盟MDR CE法规及认证流程
♦拥有丰富的有源/无源医疗器械法规注册经验以及质量体系法规经验,曾参与洲通健康项目团队数十个欧盟CE认证重点项目,并帮助多家知名医疗器械企业获得MDR CE证书
2)洲通健康MDR法规专家
♦拥有10余年医疗器械质量,研发,法规和注册经验,曾在捷迈邦美,微创神通,宁波兆盈等知名医疗器械公司担任质量工程师和法规注册主管等职
♦拥有丰富的有源/无源医疗器械法规注册经验以及质量体系法规经验,曾负责洲通健康上百个欧盟CE认证重点项目,含心脏植入物、含药器械等高风险产品,并协助多家知名医疗器械企业获得MDR CE证书
♦拥有多年医疗器械生产企业经验,有源/无源医疗器械法规注册经验以及质量体系法规经验
♦拥有丰富的欧盟MDR CE认证项目经验,负责洲通健康上百个欧盟MDR CE认证重点项目,其中包括心脏植入物、含药器械等高风险产品,并协助多家知名医疗器械企业获得MDR CE证书
4)洲通健康网络安全法规专家
♦15年以上基于Linux系统的软件开发经验
♦ 精通c语言程序设计、 Linux kernel、 Linux设备驱动、应用软件开发、RTOS、Python、机器学习和TensorFlow框架等软件编程
♦曾就职英特尔亚太研发有限公司、斑马网络科技等知名企业并担任高级软件工程师,领导并执行PSE项目(密)S22、EP21YunOS上汽车机项目、小米MiPad 2等数十种项目的测试开发工作。
5)洲通健康FDA法规专家
♦拥有多年医疗器械行业合规经验,熟悉FDA 510(K)注册流程,产品列名/工厂注册流程,Q-submission申请前咨询,美国FDA CFR 21法规等内容。
♦拥有丰富的有源/无源器械注册经验,曾参与洲通健康项目团队数十个FDA 510(K)重点项目,并帮助多家知名医疗器械企业顺利获得510(K)认证


